Иммуностимулирующее и антибактериальное действие листьев Cannabis sativa L. на цыплят-бройлеров
29.04.2024 - 289 просмотровИммуностимулирующее и антибактериальное действие листьев Cannabis sativa L. на цыплят-бройлеров
Mirta Balenović, Zlatko Janječić, Vladimir Savić, Ante Kasap, Maja Popović, Borka Šimpraga, Marijana Sokolović, Dalibor Bedeković, Goran Kiš, Tihomir Zglavnik, Daniel Špoljarić, Fani Krstulović, Ирена Листеш, Tajana Amšel Zelenika
Animals, 2024, 14(8), 1159;
https://doi.org/10.3390/ani14081159
Краткое описание
Безопасность пищевых продуктов, изменение климата, возникновение инфекционных заболеваний, запрет на использование антибиотиков в качестве стимуляторов роста и все более высокие требования к интенсивному производству являются повседневными проблемами для птицеводства. Функциональная иммунная система является необходимым условием здоровья животных, а питание является одним из модуляторов иммунной системы; следовательно, соответствующий баланс питательных веществ чрезвычайно важен для надлежащего развития и поддержания иммунной системы животных.
Антимикробное и иммуномодулирующее действие фитобиотиков - это свойства, которые делают важным их использование в качестве кормовых добавок для домашней птицы. Cannabis sativa L. содержит множество различных соединений, таких как флавоноиды, терпены и каннабиноиды, каждое из которых обладает различными свойствами и эффектами. Влияние семян, эфирных масел и жмыха C. sativa в качестве кормовых добавок для домашней птицы уже исследовалось, но влияние листьев C. sativa L. в качестве кормовой добавки на иммуностимулирующую и антибактериальную активность не исследовалось. Результаты этого исследования показывают, что C. sativa в качестве растительной добавки к корму для животных оказывает благоприятное антимикробное и иммуномодулирующее действие при выращивании цыплят-бройлеров.
АННОТАЦИЯ
Целью данного исследования было оценить влияние высушенных листьев Cannabis sativa L. в виде растительной смеси, добавляемой в корм для бройлеров, на субпопуляции Т-лимфоцитов CD4+ и CD8+, титры антител к вирусу болезни Ньюкасла (NDV) и присутствие E. coli в образцах фекалий. Исследование проводилось на 100 самцах-бройлерах Ross 308, разделенных на четыре группы по 25 бройлеров, в течение 42-дневного периода исследования. Группы содержались отдельно в ящиках на подстилке из хвойных опилок и их кормили смесью для закваски с 1 по 21 день и смесью для финиширования с 22 по 42 день.
Техническую коноплю (C. sativa) выращивали в районе Црквина, Хорватия (45°18'46.8"северной широты; 15°31'30" восточной долготы). Листья конопли были отделены вручную, высушены на солнце и измельчены в порошок. Смесь, предложенная контрольной группе, не содержала листьев каннабиса, тогда как три экспериментальные группы получали смеси, содержащие смешанные листья каннабиса в количестве 10 г/кг, 20 г/ кг или 30 г/кг (E_10, E_20 и E_30 соответственно).
Средний уровень антител к NDV был одинаковым во всех исследуемых группах до 14-го дня после вакцинации и сравнительно увеличивался со временем. Процентное содержание CD4+ и CD8+ субпопуляция лимфоцитов периферической крови показала статистически значимые различия (p < 0,001) в группе E_20 по сравнению с контрольной группой и группами E_10 и E_30 на протяжении всего периода исследования. С увеличением возраста бройлеров соотношение CD4+к CD8+ также увеличивалось и было статистически значимым (p < 0,0001) на 42-й день во всех экспериментальных группах по сравнению с контрольной группой.
Сравнение контрольной группы с опытными группами показало, что количество бактерий было ниже в группах бройлеров, получавших корм с добавлением 20 г/ кг и 30 г/ кг листьев C. sativa. В заключение, было обнаружено, что листья C. sativa оказывают благоприятное иммуномодулирующее действие на клеточно-опосредованные и гуморальные иммунные реакции у цыплят-бройлеров за счет увеличения субпопуляций лимфоцитов CD4+ и CD8+ и более высокого соотношения клеток CD4+: CD8+, что указывает на повышенную способность иммунной системы. Кроме того, листья C. sativa могут оказывать дополнительное воздействие на поствакцинальный иммунный ответ бройлеров, повышать устойчивость бройлеров к инфекционным заболеваниям, уменьшать эффект стресса, связанного с вакцинацией, и улучшать здоровье и благополучие бройлеров.
- Введение
Разведение бройлеров подвержено ряду внешних воздействий, которые часто вызывают стресс и, следовательно, снижают продуктивность. В попытке избежать потерь раньше довольно часто применяли антибиотики как средства, способствующие росту и здоровью птицы при одновременном снижении заболеваемости и смертности. Однако применение антибиотиков привело ко многим нежелательным последствиям, в первую очередь к устойчивости микроорганизмов и остаткам антибиотиков в мясе и яйцах, что неблагоприятно сказывается на здоровье человека [1,2,3]. Таким образом, Европейский парламент и Совет Европейского Союза ввели в действие Постановление 1831/2003, в котором говорится, что антибиотики, за исключением кокцидиостатов и гистомоностатов, могут продаваться и использоваться в качестве кормовых добавок только до 31 декабря 2005 года. Противококцидные средства, такие как ионофорные антибиотики, были запрещены в качестве кормовых добавок с 2013 года, когда лекарственные средства в кормах для животных были ограничены для терапевтического применения по рецепту ветеринара [4]. Мировая тенденция к сокращению использования антибиотиков на животноводческих фермах ускорила исследования по использованию альтернативных агентов, так называемых натуральных стимуляторов роста, в качестве кормовых добавок (например, пребиотиков, пробиотиков, органических кислот, ферментов, силикатов, растений, специй и т.д.) [5,6,7,8,9,10,11].
Фитобиотики известны своими фармакологическими эффектами, поэтому используются в традиционной и альтернативной медицине человека [1]. Химическая структура активного компонента фитобиотика варьируется в зависимости от сезона сбора урожая, географического происхождения и части используемого растения (листья, мякоть и т.д.). Фитобиотики могут использоваться в твердом, сушеном или измельченном виде или в виде экстрактов (сырых или концентрированных), в зависимости от процедуры, используемой для получения активного компонента [12,13]. Антимикробное и иммуномодулирующее действие фитобиотиков является важными характеристиками, которые позволяют использовать их в качестве кормовых добавок для домашней птицы [14].
Полисахариды являются очень важными иммуноактивными компонентами фитобиотиков. Растительные соединения также обладают иммуномодулирующей активностью, усиливая пролиферацию иммунных клеток, экспрессию цитокинов и титр антител. Иммуногенность фитобиотиков может проявляться в усилении активности макрофагов, лимфоцитов и естественных клеток-киллеров, а также в стимуляции выработки интерферона, так что растения, содержащие флавоноиды и каротиноиды, могут укреплять иммунную систему [15]. В своем обзоре Рафик и др. [16] подчеркнули, что фитобиотики в значительной степени используются в птицеводстве для стимуляции иммунной системы; для профилактики различных бактериальных, вирусных и протозойных заболеваний и борьбы с ними; и в качестве стимуляторов роста. Различные растения содержат природные полифенольные соединения или флавоноиды в качестве основных активных компонентов, которые исследованы в качестве потенциальных противомикробных и антиоксидантных средств. Питательный состав может напрямую влиять на иммунный ответ цыплят-бройлеров, поскольку системная иммунная система в значительной степени контролируется лимфатической тканью, связанной с кишечником. Таким образом, фитобиотики, вводимые в качестве кормовых добавок, повышают активность фагоцитов и количество лимфоцитов. Кроме того, авторы заявили, что некоторые растения повышают титр антител к вирусу болезни Ньюкасла (NDV).
С.sativa, известная как конопля, является однолетним масличным растением из семейства Cannabaceae [17]. Оно было введено в западной медицине в начале 19 века [18]. Конопля - очень актуальная культура, имеющая огромную социальную и экономическую ценность, поскольку ее можно использовать для производства продуктов питания, текстиля, одежды, биоразлагаемых пластиков, бумаги, красителей, биотоплива, кормов для животных и осветительного масла. Фитохимические компоненты, содержащиеся в конопле, очень сложны и представляют различные химические классы первичных метаболитов, таких как аминокислоты, жирные кислоты, алкалоиды и лигнаны [19,20,21].
Каннабис содержит около 600 идентифицированных и множество пока неопознанных, но потенциально полезных соединений. Однако из многочисленных уникальных химических соединений, обнаруженных в этом растении, фитоканнабиноиды являются наиболее важными [22]. Спелый каннабис содержит сотни различных соединений, которые можно разделить на категории флавоноидов, терпенов и каннабиноидов, каждый из которых обладает различными свойствами и эффектами. Соцветия каннабиса содержат каннабиноиды (15,77–20,37%), терпеноиды (1,28–2,14%) и флавоноиды 0,07–0,14%); листья содержат каннабиноиды (1,10–2,10%), терпеноиды (0,13–0,28%) и флавоноиды (0,34–0,44%); кора стебля содержит стероиды (0,07–0,08%) и тритерпеноиды (0,05–0,15%); а корни содержат стерины (0,06–0,09%) и тритерпеноиды (0,13–0,24%). Эти биологически активные соединения были основой традиционного медицинского применения каждой части растения каннабис в различных культурах на протяжении тысячелетий его культивирования [23].
Из листьев, цветков и пыльцы каннабиса было выделено более 20 типов флавоноидов, в том числе О варианты агликонов с гликозидами: апигенин, лютеолин, ориент, витексин и изовитексин, кемпферол и кверцетин, а также каннфлавин А и каннфлавин В, которые специфичны для каннабиса [24,,,]. В многочисленных исследованиях изучалось влияние пищевых флавоноидов на здоровье, рост и качество мяса птицы. Многие флавоноиды являются антиоксидантами, обладающими противовоспалительными и другими свойствами; таким образом, растительные соединения считаются потенциальной альтернативой противомикробным средствам у домашней птицы [25,26].
Большинство исследований было сосредоточено на изучении действия семян, эфирных масел и жмыха C. sativa в качестве кормовых добавок для птицы [26,27,28,29]. Макпартленд и Руссо [30] сообщили, что содержание флавоноидного компонента в листьях каннабиса составляет около 1%. Однако, согласно литературным данным, не проводилось исследований, изучающих иммунное и антибактериальное действие листьев C. sativa, добавляемых в корм для животных.
Таким образом, целью данного исследования было оценить влияние сушеных листьев C. sativa в качестве растительной смеси, добавляемой в корм для цыплят-бройлеров, на клеточную и гуморальную иммуностимуляцию и антимикробную активность.
2. Материалы и методы
2.1. Содержание животных и организация исследований
В этом исследовании приняли участие 100 бройлеров-самцов Ross 308, разделенных на четыре группы по 25 цыплят-бройлеров, выращенных в течение 42-дневного периода исследования. Группы содержались отдельно в 2 ящиках размером 1,20×1,75 м на подстилке из стружки хвойных пород. В ходе исследования цыплят-бройлеров содержали при стандартном температурном режиме (постепенное снижение с 32°C до 24°C) и назначали программу продолжительностью 23 часа на свету (L) /1 час в темноте (D) (цикл 23L: 1D). В течение всего периода исследования наблюдали за состоянием здоровья бройлеров, изменениями в поведении и смертностью.
Бройлеров кормили стартовой смесью с 1-го по 21-й день и финишной смесью с 22-го по 42-й день. Корм и вода были доступны неограниченно. Основные рационы были составлены таким образом, чтобы соответствовать пищевым потребностям цыплят-бройлеров на основе пищевых требований Aviagen [31]. Смесь, предложенная контрольной группе (C_0), не содержала листьев каннабиса, тогда как три экспериментальные группы получали смеси, содержащие смешанные листья каннабиса, т.е. 10 г/кг (группа E_10), 20 г/кг (группа E_20) или 30 г/кг (группа E_30). Ингредиенты и химический состав смесей приведены в таблице 1.
Таблица 1. Состав смеси и расчетный состав стандартных рационов, использованных в исследовании.
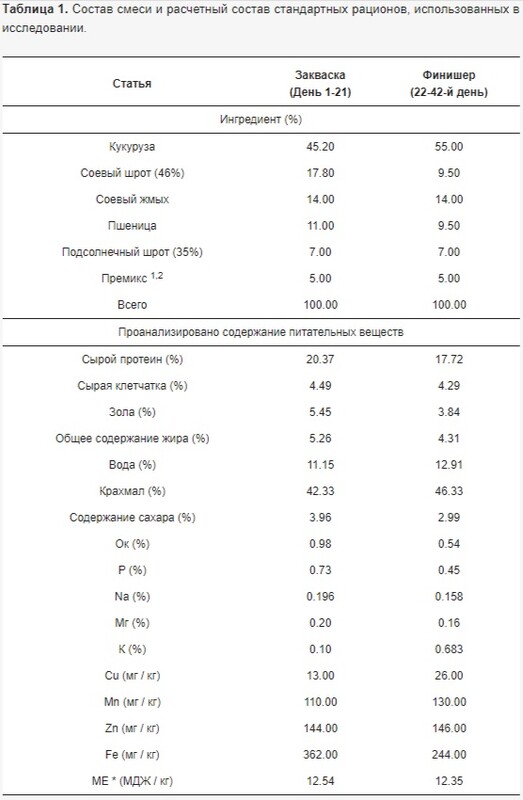

Химический состав смесей для закваски и финиширования определяли с использованием методов, рекомендованных Международной организацией по стандартизации (ISO) для сырой клетчатки (ISO 6865:2000) [32], общего жира (ISO 6492:1999) [33], воды (ISO 6496:1999) [34], белка (ISO 5983-1:2005; ISO 5983-2:2009) [35,36], крахмала (ISO 6493:2000) [37], зола (ISO 5984:2022) [38] и минералы (ISO 6491:1998) [39] P, Ca, Na, Cu, Mn, Zn, Fe, Mg и K (ISO 6869:2000) [40], а также расчет энергии метаболизма [41]. Количество сахара определяли методом Нельсона–Сомогьи [42,43].
2.2. Препарат из технической конопли (Cannabis sativa L.)
Промышленная конопля от GEA-COM Ltd. (Будачка Риека, Хорватия) выращивался в районе Црквина (широта: 45°18'46.8" северной широты; долгота: 15°31'30" Восточной долготы). На момент сбора урожая растениям было четыре месяца; то есть они находились в репродуктивной фазе. Листья конопли были отделены вручную, высушены на солнце и измельчены в порошок. Образцы растений конопли были протестированы в том виде, в каком они были получены, и после измельчения на мельнице, чтобы определить, повлиял ли процесс измельчения на конечные результаты.
Сертифицированные стандарты на каннабигерол (CBG), каннабинол (CBN) и каннабидиол (CBD) были приобретены у HPC Standards GmbH (Каннерсдорф, Германия). Метанол (MeOH) с градиентом ВЭЖХ был приобретен у Thermo Fisher Scientific (Уолтем, Массачусетс, США). Муравьиная кислота аналитического качества и все другие растворители аналитического качества были приобретены в компании Merck (Дармштадт, Германия).
2.2.1. Определение концентрации питательных веществ
После сушки в духовке (60°C в течение 72 ч) определяли следующие параметры: сырую клетчатку, общий жир (ISO 6492, 1999) [33], воду (ISO 6496, 1999) [34], белок (ISO 5983-1, 2005; ISO 5983-2, 2009) [35,36], золу (ISO 5984, 2022) [38] и минеральные вещества (ISO 6491, 1998 ) [39] P, Ca, Na, Cu, Mn, Zn, Fe, Mg и K (ISO 6869, 2000) [40].

2.2.2. Определение концентрации каннабиноидов
После сбора урожая образцы конопли сушили на воздухе в течение 2-3 недель. Перед измельчением (на электрической мельнице) образцы высушивали при 50°C в течение 12-24 ч. Для определения общего количества каннабиноидов в образцах конопли мы адаптировали метод, описанный Jin et al. [23] и Saingam and Sakunpak [44]. Вкратце, образцы (коноплю и корм) измельчали с помощью ручного лабораторного измельчителя (Retsch® Z200, Haan, Германия), и 2,0 г образца смешивали со 100 мл метанола. Экстракцию проводили при комнатной температуре путем встряхивания в течение 20 мин. Затем раствор фильтровали через фильтровальную бумагу Whatmann (черная лента). Перед введением в систему высокоэффективной жидкостной хроматографии экстракт фильтровали через фильтр из ПТФЭ толщиной 0,45 мкм. Все образцы готовили и анализировали в трех экземплярах.
Профилирование каннабиноидов в экстрактах проводили на колонке Kinetex® C18 (5 мкм C18 4,6 мм, при 30°C, Phenomenex, Торранс, Калифорния, США) с подвижной фазой, состоящей из 0,1% HCOOH в метаноле, и изократическим элюированием в течение 20 мин. Скорость потока составляла 0,7 мл / мин, объем инъекции составлял 10 мкл, и инъекции выполнялись в трех экземплярах для каждого образца.
Хроматограммы УФ/ DAD были получены при 210 нм с диапазоном регистрации всего спектра (190-400 нм). Количественные определения выбранных каннабиноидов проводили с помощью калибровочной кривой из пяти точек, построенной для каждого стандарта в одинаковых хроматографических условиях. Калибровочные кривые для каннабигерола (CBG), каннабинола (CBN) и каннабидиола (CBD) находились в диапазоне от 1 мкг / мл до 50 мкг / мл, в то время как для dTHC они находились в диапазоне от 0,1 мкг / мл до 10 мкг / мл. Качество этого метода было подтверждено определением линейности калибровочных кривых. Коэффициенты определения (R2) для CBG, CBN и CBD составили 0,9994, 0,9995 и 0,9995 соответственно. Результаты тестов по определению показателей восстановления CBG, CBN и CBD составили 96,1%, 98,3% и 93,5 соответственно.
2.3. Вакцинация цыплят- бройлеров
Суспензию вакцины против болезни Ньюкасла Avishield® ND применяли окулоназально однодневным цыплятам-бройлерам в соответствии с инструкциями производителя (Genera Inc., Калиновица, Раков Поток, Хорватия). Одна доза вакцины содержала живой лентогенный NDV, штамм La Sota, 106,0-107,0 TCID50.
2.4. Оценка титра антител к болезни Ньюкасла
В возрасте 14, 21, 28, 35 и 42 дней из каждой исследуемой группы случайным образом отобрали по 15 цыплят-бройлеров. Кровь (примерно 0,2 мл на цыплят-бройлеров) брали путем пункции вены плечевого крыла без добавления антикоагулянта. Кровь оставляли при комнатной температуре на 2 ч. Образцы сыворотки получали центрифугированием при 2500×g в течение 15 мин при 25°C, инактивировали (56°C в течение 20 мин) и хранили при -20°C до проведения анализа. Титр антител к болезни Ньюкасла определяли методом ингибирования гемагглютинации (HI) [45] с использованием 4 единиц гемагглютинации антигена. В качестве гомологичного антигена в анализе использовалась та же вакцина, что описана выше. Титр антител выражали как логарифмическую обратную величину.
2.5. Проточная цитометрия субпопуляций CD4+ и CD8+ Т-лимфоцитов в периферической крови
В возрасте 14, 21, 28, 35 и 42 дней из каждой исследуемой группы случайным образом отобрали по 10 цыплят-бройлеров. Кровь (примерно 0,2 мл на цыплят-бройлеров) брали путем пункции вены плечевого крыла с добавлением гепарина натрия в качестве антикоагулянта (Гепарин®, Belupo Inc., Копривница, Хорватия). Для идентификации субпопуляций Т-клеток использовали следующие моноклональные антитела от Southern Biotechnology Associates (Бирмингем, Алабама, США): R-PE-конъюгированные мышиные анти-куриные CD4 (кат. №8210-09) и BIOT-конъюгированные мышиные анти-куриные CD8a (кат. №8220-09). Все антитела были мышиного изотипа IgG и использовались в концентрации 1 мкг/мл. Количество лейкоцитов в образцах периферической крови (100 мл) оценивали методом проточной цитометрии (Coulter EPICS.XL, Beckman Coulter, Бреа, Калифорния, США). Образцы крови растворяли фосфатным буферным раствором (PBS) до концентрации лейкоцитов 5,0–9,7×109/л. Затем к 100 мкл подготовленной крови добавляли 50 мкл моноклональных антител против птичьих CD+ лимфоидных маркеров от Southern Biotechnology Associates (Бирмингем, Алабама, США). Образцы тестировали в трех экземплярах, и 10 000 клеток из каждого образца анализировали на проточном цитометре. Полученные значения были представлены как процент экспрессии популяции лейкоцитов в проанализированных клетках.
2.6. Бактериология
Присутствие Enterobacteriaceae и их количество в образцах фекалий бройлеров были продемонстрированы методом ISO 21528-2:2017 [46]. Объединенные образцы фекалий тестировались еженедельно. Фекалии в десятичных разведениях (от 10-1 до 10-5), предварительно приготовленные в соответствии с методами ISO 6887-6:2013 и ISO 6887-1:2017 [47,48] из трех экспериментальных групп и контрольной группы, инокулировали на кровяной агар (Колумбийский агар + 10% овечьей крови), колумбийский агар (bioMérieux, Craponne, Франция), триптоновую желчь X- глюкуроновый хромогенный агар (TBX agar, БиоМерье, Франция) и пластинчатый графинированный агар (PCA, БиоМерье, Крапон, Франция). Идентификацию E. coli проводили на масс-спектрометре Bruker Microflex LT MALDI TOF (Bruker Daltonics, Бремен, Германия), тогда как присутствие рода Salmonella было продемонстрировано с использованием метода ISO 6579-1:2017/A1:2020 [49].
2.7. Статистический анализ
Статистический анализ проводили в среде программирования R [50] с использованием нескольких различных пакетов R, таких как “tidyverse” [51] для подготовки данных; “descriptr” [52] для описательного статистического анализа; и “ggpubr” [53] и “rstatix” [54] для рекомендуемой проверки допущений применяемой статистической модели. Статистический анализ проводился в рамках двусторонней смешанной модели ANOVA с одним фактором повторных измерений (время) и одним фактором между группами (состав корма). Тест Шапиро–Уилка использовался для проверки нормальности зависимых переменных в каждой ячейке конструкции, тест Левена для проверки однородности отклонений, М-тест Бокса для проверки однородности ковариаций и тест Мочли для проверки предположения о сферичности. Предположения были выполнены по всем анализируемым признакам, за исключением предположения о нормальности для log2 титров NDV в соответствии с тестом Шапиро–Уилка. Однако графическая диагностика нормальности с помощью qqplots показала, что данные были близки к нормальному распределению, что позволило нам использовать параметрические тесты даже для этого признака. Для всех исследованных признаков (за исключением субпопуляций CD8+ Т-лимфоцитов) была определена значительная двусторонняя взаимосвязь между вышеуказанными предикторами (типом питания и временем), что указывало на то, что влияние одного фактора на переменную результата зависело от уровня другого фактора (и наоборот). Поэтому, чтобы разложить существенное двустороннее взаимодействие на простые основные эффекты, мы запустили односторонние модели первой переменной (состав корма) на каждом уровне второй переменной (время) и наоборот. Независимо от незначительного взаимодействия между предикторами, мы использовали тот же подход при анализе субпопуляций CD8+ Т-лимфоцитов для обеспечения согласованности представленных результатов. При многократных попарных сравнениях post hoc (множественные t-тесты), чтобы контролировать общую вероятность ошибки типа I (т.е.е. ложноположительных результатов), применяли поправку Бонферрони. Результаты логического статистического анализа были представлены графически с использованием “ggplot2” [55].
3. Результаты
3.1. Влияние добавления листьев C. sativa на титры антител к NDV
Наблюдалась статистически значимая взаимосвязь между составом корма и временем после вакцинации, объясняющая вариабельность титра антител к NDV в сыворотке крови (F (12, 144) = 1,97, p = 0,031) цыплят-бройлеров. Не совсем последовательное ранжирование групп кормления в разное время после вакцинации (и наоборот) затрудняло однозначные выводы. Однако в результатах были некоторые закономерности, заслуживающие интерпретации. Что касается влияния состава корма, результаты, представленные в левой части, показали, что E_20 и E_30 имели самые высокие средние титры антител к NDV в сыворотке крови и имели стабильные ранги с 3 по 6 неделю после вакцинации. Однако статистически значимые различия в титре антител к NDV были определены только между E_20 и E_10 и между E_30 и E_10 на 21-й день (р <0,05) и 28-й день (р <0,001). Определенные титры антител к NDV в разные моменты времени после вакцинации в одних и тех же группах кормления ожидаемо увеличивались со временем, за некоторыми исключениями (первоначальное снижение наблюдалось в группах C_0 и E_10 в начале исследования). Наибольшее расхождение в титре антител к NDV между исследованными смежными временными точками было определено между 4-й и 5-й неделями после вакцинации, и этот “скачок” был постоянным при всех исследованных обработках, включая C_0 и E_10. Дополнительное увеличение между 5-й и 6-й неделями было менее выраженным, особенно в группах, которым в рационе давали более высокую долю C. sativa (E_20 и E_30). Титры антител к NDV на 5-й и 6-й неделях значительно отличались от титров антител к NDV на 2-й, 3-й и 4-й неделях после вакцинации (с разным уровнем статистической значимости при попарных сравнениях). Принимая во внимание все результаты, представленные на рисунке, можно сделать вывод, что группы E_20 и E_30 имели схожие закономерности изменений за исследуемый период времени и что добавление 20 мг/ кг C. sativa в шрот оказало наиболее благоприятное влияние на свойства иммунного ответа вакцинированных цыплят-бройлеров.
ВЫВОДЫ
Было обнаружено, что листья C. sativa оказывают благоприятное иммуномодулирующее действие на клеточно-опосредованный и гуморальный иммунный ответ у цыплят-бройлеров за счет увеличения субпопуляций лимфоцитов CD4+ и CD8+ и более высокого соотношения клеток CD4+:CD8+, что указывает на усиление иммунной функции. Кроме того, листья C. sativa могут оказывать дополнительное воздействие на поствакцинальный иммунный ответ бройлеров, повышать устойчивость бройлеров к инфекционным заболеваниям, уменьшать эффект стресса, связанного с вакцинацией, и улучшать здоровье и благополучие бройлеров.
Исследования в полевых условиях показали, что кормовые добавки растительного происхождения обладают благоприятным противомикробным и иммуномодулирующим действием. Однако знания об их использовании в питании птицы остаются недостаточными, что требует дополнительных исследований и поддержки сельского хозяйства посредством производства кормовых добавок из местных растений и специй. Точный механизм действия каждого конкретного фитобиотика определить сложно, поскольку они содержатся в растениях в виде различных смесей. Это также может быть причиной различий в их эффектах среди предыдущих исследований. В птицеводстве уже давно предпринимаются усилия по улучшению благосостояния животных. Учитывая пока ограниченные знания о действии листьев C. sativa, следует изучить влияние метода сушки и хранения на их антимикробные и иммуномодулирующие свойства, а также оценить возможную токсичность для хозяина. Внимание также следует уделять результатам продуктивности, а также качеству мяса и его питательной ценности как пищи для человека.
Оптимизация производства молока из семян конопли с помощью метода анализа поверхности отклика
Образцы с натуральными антиоксидантами имели более низкий показатель PV в течение хранения


 Разработка cайта
Разработка cайта